Científicos de Cambridge crean embrión de ratón «sintético» a partir de células madre
PorEuropa Press
26/08/2022 - 5:04 pm
Artículos relacionados.
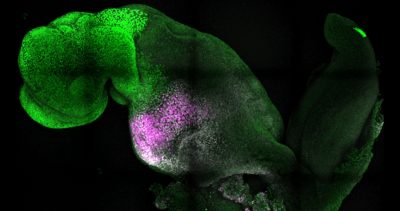
Los resultados de la investigación liderado por la profesora Magdalena Zernicka-Goetz de la Universidad de Cambridge y Caltech lograron formar un cerebro, corazón latente y cimientos de demás órganos de un ratón.
MADRID, 26 Ago. (EUROPA PRESS).- Investigadores de la Universidad de Cambridge, en Reino Unido, han creado embriones modelo a partir de células madre de ratón que forman un cerebro, un corazón que late y los cimientos de todos los demás órganos del cuerpo, en lo que constituye una nueva vía para recrear las primeras etapas de la vida, según publican en la revista Nature.
El equipo, dirigido por la profesora Magdalena Zernicka-Goetz, desarrolló el modelo de embrión sin óvulos ni espermatozoides, y en su lugar utilizó células madre, las células maestras del cuerpo, que pueden convertirse en casi cualquier tipo de célula del organismo. Imitaron los procesos naturales en el laboratorio guiando los tres tipos de células madre que se encuentran en el desarrollo temprano de los mamíferos hasta el punto en que empiezan a interactuar. Al inducir la expresión de un conjunto concreto de genes y establecer un entorno único para sus interacciones, los investigadores consiguieron que las células madre «hablaran» entre sí.
Las células madre se autoorganizaron en estructuras que progresaron a través de las sucesivas etapas de desarrollo hasta tener corazones que latían y las bases del cerebro, así como el saco vitelino donde el embrión se desarrolla y obtiene los nutrientes en sus primeras semanas. A diferencia de otros embriones sintéticos, los modelos desarrollados por Cambridge alcanzaron el punto en el que todo el cerebro, incluida la parte anterior, comenzó a desarrollarse. Se trata de un punto de desarrollo más avanzado del que se ha alcanzado en cualquier otro modelo derivado de células madre.
Scientists have created “synthetic” mouse embryos from stem cells without sperm, egg or a womb.
The feat could lay the foundation for creating synthetic human embryos for research in the future. https://t.co/heEwimFEAt pic.twitter.com/mqtl8QiTUq
— The Associated Press (@AP) August 25, 2022
El equipo afirma que sus resultados, fruto de más de una década de investigación que ha conducido progresivamente a estructuras embrionarias cada vez más complejas, podrían ayudar a los investigadores a entender por qué algunos embriones fracasan mientras que otros llegan a desarrollarse en un embarazo sano. Además, los resultados podrían utilizarse para guiar la reparación y el desarrollo de órganos humanos sintéticos para trasplantes.
«Nuestro modelo de embrión de ratón no sólo desarrolla un cerebro, sino también un corazón que late, y todos los componentes que conforman el cuerpo —afirma Zernicka-Goetz, catedrática de Desarrollo de Mamíferos y Biología de Células Madre del Departamento de Fisiología, Desarrollo y Neurociencia de Cambridge—. Es increíble que hayamos llegado tan lejos».
Para que un embrión humano se desarrolle con éxito, es necesario que haya un «diálogo» entre los tejidos que se convertirán en el embrión y los que lo conectarán con la madre. En la primera semana tras la fecundación se desarrollan tres tipos de células madre: una acabará convirtiéndose en los tejidos del cuerpo, y las otras dos apoyan el desarrollo del embrión. Uno de estos tipos de células madre
extraembrionarias se convertirá en la placenta, que conecta al feto con la madre y le proporciona oxígeno y nutrientes; y el segundo es el saco vitelino, donde crece el embrión y del que obtiene sus nutrientes en las primeras etapas del desarrollo.

Muchos embarazos fracasan en el momento en que los tres tipos de células madre comienzan a enviar señales mecánicas y químicas entre sí, que indican al embrión cómo desarrollarse correctamente. «Muchos embarazos fracasan en este momento, antes de que la mayoría de las mujeres se den cuenta de que están embarazadas —explica Zernicka-Goetz, que también es profesora de Biología e Ingeniería Biológica en Caltech—. Este periodo es la base de todo lo que sigue en el embarazo. Si va mal, el embarazo fracasará».
Durante la última década, el grupo de la profesora Zernicka-Goetz en Cambridge ha estudiado estas primeras etapas del embarazo, para entender por qué algunos embarazos fracasan y otros tienen éxito. «El modelo de embrión de células madre es importante porque nos da accesibilidad a la estructura en desarrollo en una etapa que normalmente se nos oculta debido a la implantación del diminuto embrión en el útero de la madre —añade Zernicka-Goetz—. Esta accesibilidad nos permite manipular los genes para comprender sus funciones de desarrollo en un sistema experimental modelo».
Para guiar el desarrollo de su embrión sintético, los investigadores juntaron células madre cultivadas que representaban cada uno de los tres tipos de tejido en las proporciones y el entorno adecuados para promover su crecimiento y comunicación entre sí, para finalmente autoensamblarse en un embrión.
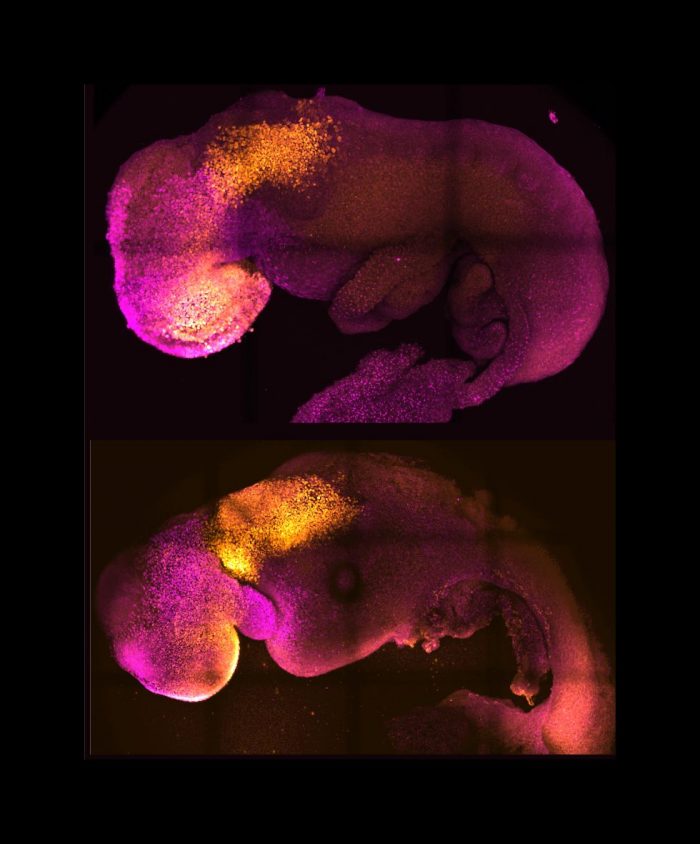
Los investigadores descubrieron que las células extraembrionarias envían señales químicas a las células embrionarias, pero también mecánicas, o a través del tacto, guiando el desarrollo del embrión. «Este periodo de la vida humana es muy misterioso, así que poder ver cómo se produce en una placa -tener acceso a estas células madre individuales, entender por qué fracasan tantos embarazos y cómo podríamos evitarlo- es muy especial —prosigue Zernicka-Goetz—. Hemos estudiado el diálogo que tiene que producirse entre los distintos tipos de células madre en ese momento; hemos demostrado cómo se produce y cómo puede ir mal».
Un gran avance del estudio es la capacidad de generar todo el cerebro, en particular la parte anterior, que ha sido un objetivo importante en el desarrollo de embriones sintéticos. Esto funciona en el sistema de Zernicka-Goetz porque esta parte del cerebro requiere señales de uno de los tejidos extraembrionarios para poder desarrollarse. El equipo pensó que esto podría tener lugar a partir de sus estudios de 2018 y 2021, que utilizaron las mismas células componentes para desarrollarse en embriones en una fase ligeramente anterior. Ahora, al llevar el desarrollo un día más allá, pueden afirmar definitivamente que su modelo es el primero que señala el desarrollo de la parte anterior, y de hecho de todo el cerebro.
«Esto abre nuevas posibilidades para estudiar los mecanismos del neurodesarrollo en un modelo experimental —subraya ZernickaGoetz—. De hecho, en el artículo demostramos la prueba de este principio eliminando un gen que ya se sabe que es esencial para la formación del tubo neural, precursor del sistema nervioso, y para el desarrollo del cerebro y los ojos. En ausencia de este gen, los embriones sintéticos muestran exactamente los defectos conocidos en el desarrollo del cerebro como en un animal portador de esta mutación. Esto significa que podemos empezar a aplicar este tipo de enfoque a los muchos genes con función desconocida en el desarrollo del cerebro».

Aunque la investigación actual se llevó a cabo en modelos de ratón, los investigadores están desarrollando modelos humanos similares con el potencial de dirigirse a la generación de tipos de órganos específicos para comprender los mecanismos que subyacen a procesos cruciales que, de otro modo, serían imposibles de estudiar en embriones reales. En la actualidad, la legislación británica sólo permite estudiar embriones humanos en el laboratorio hasta el 14º día de desarrollo.
Si en el futuro los métodos desarrollados por el equipo de Zernicka-Goetz dan buenos resultados con células madre humanas, también podrían utilizarse para guiar el desarrollo de órganos sintéticos para pacientes que esperan un trasplante. «Hay muchas personas en todo el mundo que esperan durante años un trasplante de órganos —recuerda—. Lo que hace que nuestro trabajo sea tan emocionante es que los conocimientos que surjan de él podrían utilizarse para cultivar órganos humanos sintéticos correctos para salvar vidas que actualmente se pierden. También debería ser posible afectar y curar órganos adultos utilizando los conocimientos que tenemos sobre cómo se fabrican».
«Este es un paso adelante increíble y ha supuesto 10 años de duro trabajo de muchos miembros de mi equipo; nunca pensé que llegaríamos a este punto. Nunca piensas que tus sueños se harán realidad, pero así ha sido».