¿Por qué hay quienes enferman más de COVID que otros? 11 genes serían responsables
PorEuropa Press
09/05/2022 - 11:14 am
Artículos relacionados.
Con el tiempo, la ciencia ha ido encontrando respuestas a las dudas en torno a la COVID, sin embargo, algunas aún persisten. Para identificar qué está detrás de que algunos enfermen peor por el virus, expertos crearon un modelo en ratones que parece haber dado con la causa.
Madrid, 9 de mayo (Europa Press).- Un nuevo estudio realizado un equipo de investigadores de los Laboratorios Nacionales de Enfermedades Infecciosas Emergentes (NEIDL) de la Universidad de Boston y la Universidad de Princeton, en Estados Unidos, sobre el virus de la COVID-19 en el pulmón sugiere que existen 11 genes que definen la protección frente a la infección, lo que daría respuesta a por qué algunas personas se enferman más que otras de COVID-19, y, lo que es más importante, podría ayudar a muchos a evitar los peores síntomas.
Las vacunas COVID-19 han salvado al menos un millón de vidas sólo en los Estados Unidos, pero para muchas personas, persiste un temor persistente: si, o cuando, se ven afectados por el coronavirus, ¿qué tan grave será? ¿Saldrán adelante con poco más que un dolor de garganta, o los cargará con complicaciones a largo plazo, tal vez incluso los lleve al borde de la muerte?
Desde que el SARS-CoV-2 comenzó a principios de 2020, la COVID-19 se ha cobrado seis millones de vidas y sigue aumentando, según la Organización Mundial de la Salud, que estima que ha provocado de manera directa o indirecta más de 15 millones de muerte. Y, sin embargo, la gran mayoría de las personas que han contraído COVID, alrededor del 99 por ciento de los más de 500 millones de casos confirmados, han sobrevivido a su contacto con la enfermedad.
https://twitter.com/RobotRrid/status/1515314112019922945
Entonces, ¿por qué algunas personas se ven tan gravemente afectadas por la COVID cuando a muchas apenas les hace daño? La edad y otras condiciones de salud aumentan el riesgo de enfermarse gravemente, pero un nuevo estudio sugiere que aquellos que escapan a los peores síntomas también podrían tener el equilibrio adecuado de un tipo de células inmunitarias llamadas macrófagos.
Los glóbulos blancos que se encuentran en todos los tejidos, los macrófagos, parte de un grupo de células llamadas células mieloides, los protectores del sistema inmunitario, son curanderos. Son cruciales en la reparación de heridas, ya que se transmiten a una lesión para ayudar al cuerpo a repararse. También atacan a los invasores, engullen y digieren todo lo que parece no pertenecer al cuerpo, desde células muertas hasta bacterias dañinas. Ese modo de ataque nos ayuda a mantenernos saludables, pero también parece ser un factor en los casos graves de COVID-19.
Ha ido creciendo la evidencia de que muchas muertes por COVID son causadas por una respuesta hiperinmune: macrófagos arrasadores que atacan no sólo al virus, sino también a nuestros cuerpos, causando una inflamación excesiva y dañando el tejido cardíaco y pulmonar.
El estudio, publicado en Cell Reports analizó por qué sucedía eso y examinaron el impacto de la COVID en quienes se enferman peligrosamente y en quienes no. Al estudiar los pulmones que parecen desviar fácilmente el SARS-CoV-2 o recuperarse rápidamente de la infección, encontraron un conjunto de genes que determinan si las células inmunitarias montan una defensa sólida o se vuelven rebeldes y colocan a alguien en un ventilador. Los hallazgos podrían ayudar a los esfuerzos para desarrollar nuevos medicamentos que preparen mejor los sistemas inmunológicos para combatir el virus.

«Si puede comprender por qué la mayoría de las personas están protegidas contra la COVID y cómo las protege su cuerpo, entonces podría aprovechar este conocimiento para desarrollar terapias y otros avances», explica Florian Douam, profesor asistente de microbiología de la Facultad de Medicina de la BU que coordinó el estudio.
¿POR QUÉ ALGUNOS PULMONES ESTÁN PROTEGIDOS CONTRA LA COVID?
Después de dos años de enfermedad y pruebas, los científicos saben mucho sobre cómo se transmite el SARS-CoV-2 y cómo reaccionan nuestros cuerpos cuando lo contraemos, pero también hay mucho que no entienden. Tome los pulmones: sabemos que el COVID-19 puede dejar los pulmones llenos de líquido e inflamados, a veces con cicatrices de sepsis. Pero la mayor parte de lo que se sabe sobre COVID en los pulmones se basa en muestras tomadas de quienes murieron a causa de la enfermedad, no de quienes la sobrevivieron.
«Sólo se puede acceder al pulmón cuando el paciente muere. Obviamente, no puedes conseguir a alguien que tenía una enfermedad leve y decirle: ‘Oh, dame tu pulmón’. A diferencia de las muestras de autopsia de pulmón de pacientes enfermos, los pulmones de pacientes más leves o asintomáticos son mucho más difíciles de acceder. Cuando tienes el pulmón enfermo, obtienes una instantánea de la enfermedad en etapa terminal», afirma Douam, que trabaja en NEIDL.
Para superar este desafío, Douam y el equipo de investigación desarrollaron un nuevo modelo, un ratón injertado con tejido pulmonar humano y reforzado con un sistema inmunológico humano derivado de células madre, para monitorear las diferentes etapas de la infección por SARS-CoV-2 y COVID-19. Douam dice que los ratones con tejido pulmonar humano, pero sin el sistema inmunitario humano, no reaccionan bien a la infección: los tejidos pulmonares se dañan de manera similar a las personas con un caso grave de la enfermedad. Pero cuando estudiaron ratones que también tenían un sistema inmunológico humanizado, fue diferente.
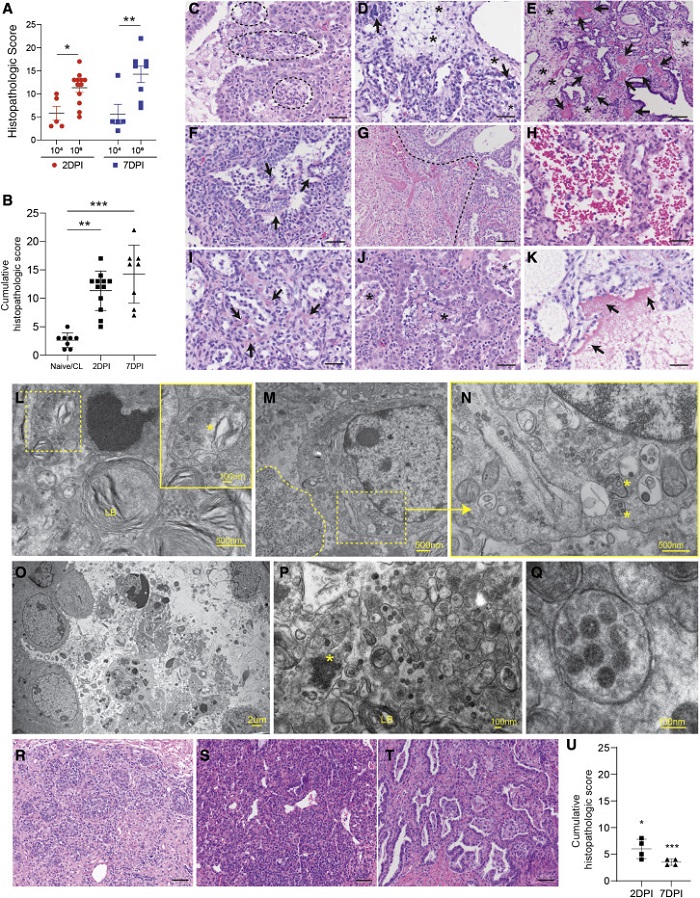
«Apenas veíamos virus en los pulmones. El pulmón estaba protegido. Entonces hicimos la pregunta, ‘¿Por qué está protegido el pulmón?’ Y aquí es donde encontramos los macrófagos». Según Devin Kenney, estudiante de doctorado en el laboratorio de Douam y autor principal del último artículo, una característica de los pulmones que se vieron más gravemente afectados por la COVID fue la falta de diversidad de macrófagos. Estaban dominados por un macrófago proinflamatorio, las células que generalmente responden a virus y bacterias, llamado M1.
«Parece que impulsan esta respuesta hiperinflamatoria, y conduce a un estado de enfermedad más grave», explica Kenney (MED’27). Por el contrario, a los sistemas inmunitarios que mezclaron más células que normalmente ayudan en la reparación de heridas (M2 o macrófagos reguladores) les fue mejor.
«Si tiene una población de macrófagos más diversa que tiene macrófagos reguladores e inflamatorios, puede regular de manera más efectiva las señales que impulsan las respuestas antivirales, apagándolas cuando sea apropiado. Entonces, el sistema inmunitario puede eliminar el virus muy rápidamente y proteger el tejido», señala.
Los investigadores vincularon esta respuesta antiviral positiva a un conjunto de 11 genes que llamaron «genes que definen la protección». En casos de resistencia efectiva, estos genes trabajaban más, o lo que se conoce como regulación positiva. «Ahora sabemos que los macrófagos no sólo pueden promover la protección en el tejido pulmonar. También conocemos el conjunto clave de genes que estos macrófagos necesitan expresar para proteger el pulmón», explica.
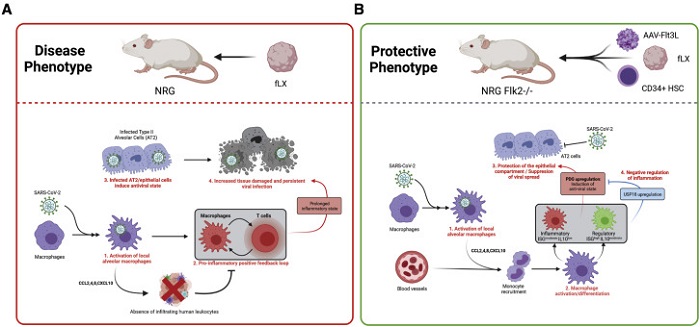
Lo que aún no saben es por qué algunas personas pueden poner a trabajar una mezcla diversa de macrófagos mientras que otras no. Ese es un objetivo para futuros estudios.