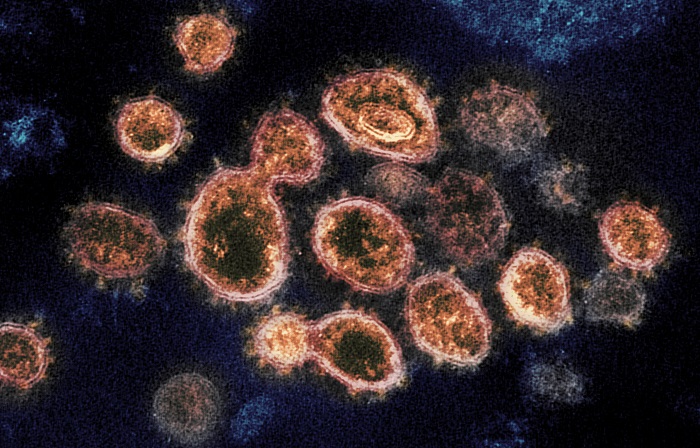
Desde que dio a conocer los resultados preliminares, AstraZeneca aceptó un error clave en la dosis de la vacuna recibida por algunos participantes del estudio, lo que se suma a preguntas sobre si la eficacia aparentemente espectacular de la vacuna se mantendrá bajo pruebas adicionales.
Ciudad de México, 26 de noviembre (SinEmbargo).– Era –o todavía puede ser, difícil saberlo– la vacuna ideal contra el coronavirus: barata y fácil de fabricar. Y además, se dijo que tenía hasta un 90 por ciento de efectividad. La de AstraZeneca y la Universidad de Oxford podría costar menos que una rebanada de pastel en Starbucks y no planteaba los retos de la de Pfizer o la de Moderna, que requieren temperaturas de congelación que dan frío, por la mecánica para movilizarla y el precio que supone.
La buena noticia para México era doble: no sólo porque daba esperanzas como a todos los demás, sino porque hay una fuerte apuesta a esta vacuna. Hasta la fundación del hombre más rico de México, Carlos Slim, se involucró.
Pero desde que dio a conocer los resultados preliminares, AstraZeneca aceptó un error clave en la dosis de la vacuna recibida por algunos participantes del estudio, lo que se suma a preguntas sobre si la eficacia aparentemente espectacular de la vacuna se mantendrá bajo pruebas adicionales. Los científicos y expertos de la industria dijeron que el error, y una serie de otras irregularidades y omisiones en la forma en que AstraZeneca reveló inicialmente los datos han erosionado su confianza. Lástima.
Los funcionarios de Estados Unidos han señalado que los resultados no fueron claros. Fue el director de la principal iniciativa federal de vacunas, no la empresa, quien reveló por primera vez que los resultados más prometedores de la vacuna no reflejaban datos de personas mayores. El resultado, dijeron los expertos, es que las probabilidades de que los reguladores en los Estados Unidos y en otros lugares autoricen rápidamente el uso de emergencia de la vacuna AstraZeneca están disminuyendo, un revés inesperado en la campaña mundial para acorralar la devastadora pandemia.
En una entrevista el miércoles, Menelas Pangalos, el ejecutivo de AstraZeneca a cargo de gran parte de la investigación y el desarrollo de la empresa, defendió el manejo de las pruebas por parte de la empresa y sus divulgaciones públicas. Dijo que el error en la dosificación fue cometido por un contratista y que, una vez que se descubrió, los reguladores fueron notificados de inmediato y aprobaron el plan para continuar probando la vacuna en diferentes dosis.
«Independientemente de la forma en que corte los datos […] todavía tenemos una eficacia que cumple con los umbrales para la aprobación con una vacuna que tiene más del 60 por ciento de eficacia», subrayó, ya que la Organización Mundial de la Salud (OMS) estableció un objetivo de 50 por ciento de eficacia para las vacunas contra la COVID-19.
Cuando se le preguntó por qué compartió cierta información con analistas de Wall Street y algunos otros funcionarios y expertos, pero no con el público, Pangalos respondió: “Creo que la mejor manera de reflejar los resultados es en una revista científica revisada por pares, no en un periódico”.
Y ya este día, ante la serie de dudas que se desataron alrededor del mundo, se dio a conocer que es probable que AstraZeneca lleve a cabo una prueba global adicional para evaluar la eficacia de su vacuna, según informó Bloomberg, citando al director ejecutivo de la compañía.
AstraZeneca fue la tercera compañía este mes en informar resultados iniciales alentadores sobre una candidata a vacuna contra el coronavirus. A primera vista, el lunes por la mañana, los resultados parecían prometedores. Dependiendo de la concentración a la que se administraron las dosis, la vacuna pareció tener una efectividad del 90 o del 62 por ciento. La eficacia promedio, dijeron los desarrolladores, fue del 70 por ciento. Sin embargo, casi de inmediato surgieron dudas sobre los datos.
El 24 de noviembre empezó a revelarse todo. Parecía inicialmente como un golpe de suerte, y no un error (como terminó siendo).
“Es sorprendente, pero tampoco me parece una locura que tu sistema inmune reaccione un poquito cuando le das una dosis más baja y que luego, cuando le das una segunda dosis más alta, desarrolle una respuesta mucho mayor. A veces en ciencia pasan cosas que no nos esperamos. También por eso se hacen los estudios: para descubrir cosas que nos pueden parecer contraintuitivas”, dijo en una entrevista con ElDiario.es el neurólogo español Carlos Estévez Fraga, que participó en los ensayos clínicos de la vacuna en su hospital University College de Londres (UCL).
Lo que sucedió, se explicó, es que los ensayos de AstraZeneca alcanzaron la eficacia del 90 por ciento por error. Fue error, se asumió, pero un golpe de buena suerte. Sin querer usaron una media dosis primero, luego una dosis completa y el cuerpo de los voluntarios reaccionó de manera inesperada. Primero, tuvo pocos efectos secundarios. Luego, en la segunda dosis completa, el cuerpo elevó la eficiencia.
“La razón por la que usamos la media dosis es una casualidad”, aceptó a la agencia Reuters Mene Pangalos, jefe de investigación y desarrollo no oncológicos del laboratorio británico. Resulta que a finales de abril, los investigadores universitarios administraron las primeras dosis a los participantes del ensayo en Gran Bretaña y pronto, dijo Reuters, notaron que los efectos secundarios anticipados, como fatiga, dolores de cabeza o de brazos, eran más leves de lo esperado. “Así que retrocedimos y verificamos”, agregó. “Y descubrimos que habían gastado la mitad de la dosis de la vacuna”.
Pero aún con este “regalo de Navidad” había preguntas: ¿Por qué había una variación tan grande en la eficacia de la vacuna en diferentes dosis y por qué una dosis más pequeña parecía producir resultados mucho mejores? Los investigadores de AstraZeneca y Oxford dijeron que no lo sabían. También faltaba información crucial. La compañía dijo que el análisis inicial se basó en 131 casos sintomáticos de COVID-19 que habían aparecido en los participantes del estudio. Pero no desglosó cuántos casos se encontraron en cada grupo de participantes: los que recibieron la dosis inicial de concentración media, la dosis inicial de concentración regular y el placebo.

«El comunicado de prensa planteó más preguntas de las que respondió», dijo John Moore a The New York Times. Es un profesor de microbiología e inmunología en Weill Cornell Medical College.
Desde que el equipo Oxford-AstraZeneca emergió como líder en la carrera para desarrollar una vacuna esta primavera, el Primer Ministro de Gran Bretaña, Boris Johnson, abrazó el esfuerzo. El Gobierno ordenó por adelantado 100 millones de dosis y calificó la investigación como una de las contribuciones más importantes del país a la lucha contra la pandemia. Al disfrutar de los resultados del lunes, Johnson afirmó que la vacuna “tiene los ingredientes de un maravilloso logro científico británico”.
En los Estados Unidos, que ordenó al menos 300 millones de dosis de la vacuna de AstraZeneca, el camino regulatorio a seguir no está claro. AstraZeneca fue prudente el lunes sobre sus planes para buscar la aprobación regulatoria. La compañía dijo que buscará orientación de la Administración de Alimentos y Medicamentos (FDA) sobre si debe presentar formalmente sus hallazgos para solicitar una autorización de emergencia.
AstraZeneca no ha estado probando la prometedora dosis inicial de concentración media en su ensayo en curso en los Estados Unidos. La compañía dijo que trabajaría con la agencia para agregarlo lo más rápido posible a esa prueba.
Por lo pronto, esto ha resultado un balde de agua fría en un mundo enfermo de algo más que un resfriado.