«En este estudio nos centramos en las variantes británica, sudafricana y brasileña, pero se podría adaptar fácilmente la plataforma de diagnóstico para abordar la variante Delta y otras que están surgiendo», afirmó el investigador James Collins.
Madrid, 9 de agosto (Europa Press).- Ingenieros del Instituto Tecnológico de Massachusetts (MIT) y de la Universidad de Harvard, en Estados Unidos, han diseñado un pequeño dispositivo de sobremesa que puede detectar el SARS-CoV-2 a partir de una muestra de saliva en aproximadamente una hora. En su nuevo estudio, publicado en la revista Science Advances, han demostrado que el diagnóstico es tan preciso como las pruebas de PCR que se utilizan actualmente.
El dispositivo también puede utilizarse para detectar mutaciones víricas específicas relacionadas con algunas de las variantes del SRAS-CoV-2 que circulan actualmente. Este resultado también puede obtenerse en una hora, lo que podría facilitar el seguimiento de las distintas variantes del virus, especialmente en regiones que no tienen acceso a instalaciones de secuenciación genética.
«Demostramos que nuestra plataforma puede programarse para detectar las nuevas variantes que surjan, y que podríamos reutilizarla con bastante rapidez», afirma James Collins, profesor Termeer de Ingeniería y Ciencias Médicas en el Instituto de Ingeniería y Ciencias Médicas (IMES) y el Departamento de Ingeniería Biológica del MIT.
Minimally instrumented SHERLOCK (miSHERLOCK) for CRISPR-based point-of-care diagnosis of SARS-CoV-2 and emerging variants https://t.co/jqDabSwWmf
— Georgewilliam (@KalibbalaG) August 9, 2021
«En este estudio nos centramos en las variantes británica, sudafricana y brasileña, pero se podría adaptar fácilmente la plataforma de diagnóstico para abordar la variante Delta y otras que están surgiendo», explica.
El nuevo diagnóstico, que se basa en la tecnología CRISPR, puede ensamblarse por unos 15 dólares (unos 12.6 euros), pero esos costos podrían reducirse significativamente si los dispositivos se produjeran a gran escala, dicen los investigadores.
El nuevo diagnóstico se basa en SHERLOCK, una herramienta basada en CRISPR que Collins y otros informaron por primera vez en 2017. Los componentes del sistema incluyen una cadena guía de ARN que permite la detección de secuencias específicas de ARN objetivo, y enzimas Cas que escinden esas secuencias y producen una señal fluorescente. Todos estos componentes moleculares pueden liofilizarse para su almacenamiento a largo plazo y reactivarse al exponerse al agua.
El año pasado, el laboratorio de Collins comenzó a trabajar en la adaptación de esta tecnología para detectar el virus del SARS-CoV-2, con la esperanza de poder diseñar un dispositivo de diagnóstico que pudiera dar resultados rápidos y ser operado con poca o ninguna experiencia. También querían que funcionara con muestras de saliva, lo que facilitaría aún más su uso.
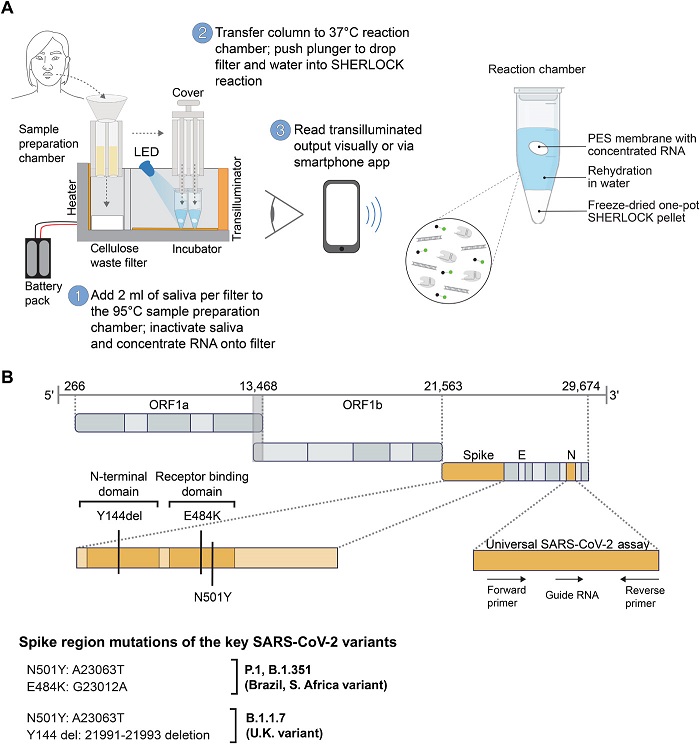
Para conseguirlo, los investigadores tuvieron que incorporar un paso crítico de preprocesamiento que desactivara unas enzimas llamadas nucleasas salivales, que destruyen ácidos nucleicos como el ARN. Una vez que la muestra entra en el dispositivo, las nucleasas se inactivan mediante calor y dos reactivos químicos. A continuación, se extrae el ARN viral y se concentra haciendo pasar la saliva por una membrana.
«Esa membrana fue la clave para recoger los ácidos nucleicos y concentrarlos de manera que podamos obtener la sensibilidad que estamos mostrando con este diagnóstico», afirma Rose Lee, instructora de pediatría del Hospital Infantil de Boston y del Centro Médico Beth Israel Deaconess y becaria visitante del Instituto Wyss.
A continuación, esta muestra de ARN se expone a los componentes CRISPR/Cas liofilizados, que se activan mediante la punción automática de paquetes de agua sellados dentro del dispositivo. La reacción de un solo paso amplifica la muestra de ARN y luego detecta la secuencia de ARN objetivo, si está presente.
«Nuestro objetivo era crear un diagnóstico totalmente autónomo que no requiriera ningún otro equipo –afirma Xiao Tan, becaria clínica del Instituto Wyss e instructora de gastroenterología del Hospital General de Massachusetts-. Esencialmente, el paciente escupe en este dispositivo, y luego se presiona un émbolo y se obtiene una respuesta una hora después».
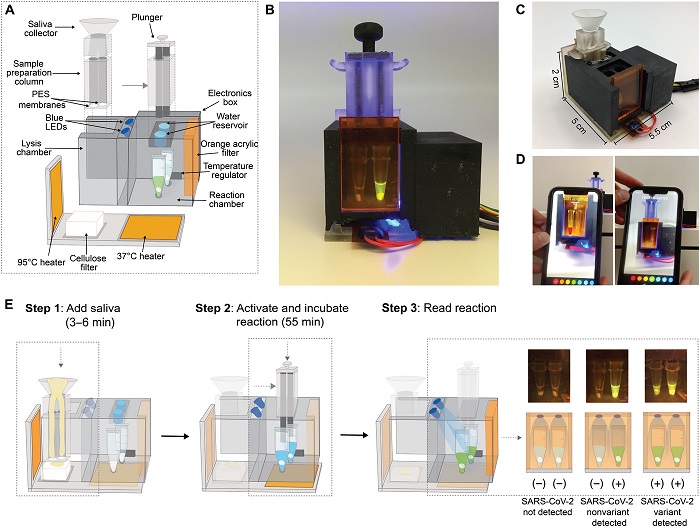
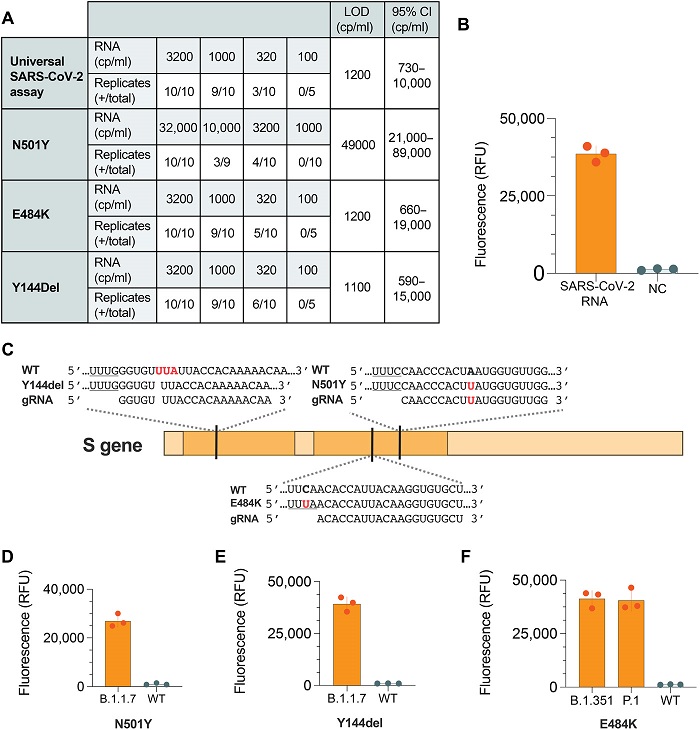
Los investigadores diseñaron el dispositivo, al que llaman SHERLOCK mínimamente instrumentado (miSHERLOCK), de modo que pueda tener hasta cuatro módulos que busquen cada uno una secuencia de ARN objetivo diferente. El módulo original contiene cadenas guía de ARN que detectan cualquier cepa de SARS-CoV-2. Otros módulos son específicos para las mutaciones asociadas a algunas de las variantes que han surgido en el último año, como B.1.1.7, P.1 y B.1.351.
La variante Delta aún no estaba extendida cuando los investigadores realizaron este estudio, pero como el sistema ya está construido, dicen que debería ser sencillo diseñar un nuevo módulo para detectar esa variante. El sistema también podría programarse fácilmente para vigilar nuevas mutaciones que pudieran hacer que el virus fuera más infeccioso.
«Si se quiere hacer un estudio epidemiológico más amplio, se pueden diseñar ensayos antes de que aparezca una mutación preocupante en una población, para vigilar las mutaciones potencialmente peligrosas en la proteína de la espiga», dice Devora Najjar, estudiante graduada del Laboratorio de Medios del MIT.
Los investigadores probaron primero su dispositivo con saliva humana enriquecida con secuencias sintéticas de ARN del SARS-CoV-2, y después con unas 50 muestras de pacientes que habían dado positivo en las pruebas del virus. Comprobaron que el dispositivo era tan preciso como las pruebas de PCR de referencia que se utilizan actualmente, que requieren hisopos nasales y requieren más tiempo y un hardware y una manipulación de las muestras considerablemente mayores para obtener resultados.
El dispositivo produce una lectura fluorescente que puede verse a simple vista, y los investigadores también diseñaron una aplicación para teléfonos inteligentes que puede leer los resultados y enviarlos a los departamentos de salud pública para facilitar su seguimiento.
Los investigadores creen que su dispositivo podría fabricarse a un costo de entre dos y tres euros por aparato. Si es aprobado por la FDA y fabricado a gran escala, prevén que este tipo de diagnóstico podría ser útil tanto para las personas que quieren poder hacer la prueba en casa, como en los centros de salud de zonas sin acceso generalizado a las pruebas de PCR o a la secuenciación genética de las variantes del SARS-CoV-2.
«La capacidad de detectar y rastrear estas variantes es esencial para una salud pública eficaz, pero, por desgracia, en la actualidad las variantes sólo se diagnostican mediante la secuenciación de ácidos nucleicos en centros epidemiológicos especializados que son escasos incluso en los países con recursos», afirma Helena de Puig, postdoctorada del Instituto Wyss de Ingeniería Inspirada en la Biología de la Universidad de Harvard.