Este fármaco ha dado resultados alentadores en los ensayos, además de facilitar su administración.
Por Francisco López-Muñoz
Profesor Titular de Farmacología y Vicerrector de Investigación y Ciencia de la Universidad Camilo José Cela, Universidad Camilo José Cela
Jose Antonio Guerra Guirao
Profesor de Farmacología y Toxicología. Facultad de Farmacia. Universidad Complutense de Madrid., Universidad Complutense de Madrid
Madrid, 8 de noviembre (The Conversation).- Desde el inicio de la pandemia de COVID-19, las compañías farmacéuticas comenzaron una desesperada carrera por obtener un agente antiviral capaz de detener la replicación y transmisión del coronavirus SARS-CoV-2. Además, han estudiado diferentes fármacos para el tratamiento sintomatológico de la enfermedad con resultados no demasiado alentadores.
Hasta el momento han sido ensayados más de 400 principios activos para el tratamiento de la infección por SARS-CoV-2. Entre los antivirales, se han aplicado el remdesivir y el baricitinib. Además se están evaluando otros, como el favipiravir y el merimepodib.
Sin embargo, el 4 de noviembre de 2021 las agencias reguladoras del Reino Unido (MHRA) y de la Unión Europea (EMA) informaban, con una diferencia de varias horas, de la aprobación, mediante procedimiento de emergencia, de un nuevo fármaco antiviral de administración oral para el tratamiento de la COVID-19.

Se trata del molnupiravir, de las compañías farmacéuticas Merck Sharp & Dohme y Ridgeback Biotherapeutics.
¿QUÉ ES EL MOLNUPIRAVIR Y CÓMO FUNCIONA?
El molnupiravir es un profármaco (un agente farmacológico que necesita activarse dentro del cuerpo) del análogo ribonucleósido activo β-d-N4-hidroxicitidina. Esta (NHC, EIDD-1931) es un análogo de ribonucleósido que sustituye a la citidina en la génesis del nuevo ARN viral.
Este profármaco es biodisponible por vía oral y ha demostrado una actividad antiviral de amplio espectro frente a diferentes virus ARN no relacionados, incluidos el virus de la gripe (influenza), el virus del ébola, el virus de la encefalitis equina venezolana (VEEV) y otros coronavirus.
Su mecanismo de acción consiste en introducir errores de copia durante la replicación del ARN viral, generando virus no viables. Es decir, incapaces de infectar (véase la Figura 1).
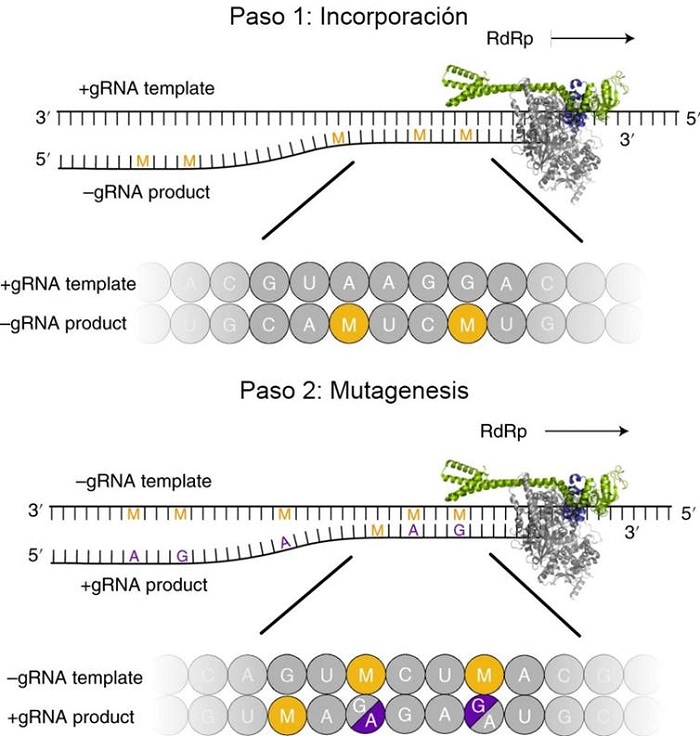
Cuando el fármaco penetra en la célula se convierte en estructuras parecidas a los nucleótidos del ARN (moléculas básicas para construir este material genético). En la primera fase, la máquina copiadora del virus, una enzima denominada ARN polimerasa, incorpora estas estructuras falsas al genoma del virus. Sin embargo, a diferencia del remdesivir, que ralentiza la ARN polimerasa viral, el molnupiravir no interfiere directamente en la función de la máquina copiadora.
En cambio, en la segunda fase, estas estructuras falsas conectan con los nucleótidos del material genético viral. De esta forma, cuando el ARN viral se replica para producir nuevos virus contiene numerosos errores (mutaciones) y da como resultado virus incapaces de sobrevivir.
LA EVIDENCIA CLÍNICA DEL MOLNUPIRAVIR COMO CLAVE DE SU AUTORIZACIÓN
Desde 2020 se estaban llevando a cabo varios ensayos clínicos autorizados en Norteamérica y la Unión Europea (Fases II y III) para evaluar la eficacia y seguridad de este fármaco en el tratamiento de la COVID-19.
Entre estos ensayos clínicos de Fase III destaca el estudio MOVe-OUT, un ensayo multicéntrico realizado en 17 países, entre ellos España, en el que se han incluido más de 700 pacientes con COVID-19 confirmada mediante PCR que no requerían hospitalización.
El objetivo primario de eficacia del estudio MOVe-OUT era evaluar la eficacia del molnupiravir frente a placebo. La variable principal de eficacia planteada era el porcentaje de pacientes que requieren hospitalización o fallecen, desde el momento de la aleatorización hasta el día 29.

Los datos obtenidos hasta el momento han posibilitado su autorización por el “procedimiento de emergencia”, según se ha informado en diferentes notas de prensa.
Los resultados obtenidos con el molnupiravir ponen de manifiesto una reducción del riesgo de hospitalización o muerte en aproximadamente un 50 por ciento de los pacientes: el 7.3 por ciento de los pacientes que recibieron molnupiravir fueron hospitalizados o murieron hasta el día 29 tras la aleatorización (28/385), en comparación con el 14.1 por ciento de los pacientes tratados con placebo (53/377). Esto supone una diferencia estadísticamente significativa (p = 0.0012).
Estos datos tan esperanzadores han motivado que, tanto en Estados Unidos como en Europa, se paralice el ensayo clínico para poder aprobar el medicamento mediante el procedimiento de emergencia. En el momento de tomar la decisión de detener el reclutamiento, basándose en los convincentes resultados provisionales de eficacia, el ensayo se acercaba al reclutamiento completo del tamaño de la muestra prevista de mil 550 pacientes (más del 90 por ciento del tamaño muestral previsto).
Un aspecto muy destacable del protocolo es que los pacientes debían tener al menos un factor de riesgo asociado a una mala evolución de la enfermedad al inicio del estudio. El molnupiravir redujo el riesgo de hospitalización o muerte en todos los subgrupos clave y la eficacia no se vio afectada por el momento de inicio de los síntomas o el factor de riesgo subyacente.
Además, basándose en los participantes con datos de secuenciación viral disponibles (aproximadamente el 40 por ciento de los participantes), el molnupiravir demostró una eficacia consistente en las variantes virales Gamma, Delta y Mu.

Con respecto a la seguridad, según se indica en la ficha técnica provisional, en el análisis intermedio del ensayo clínico MOVe-OUT en pacientes con covid-19 leve a moderada tratados con molnupiravir (n = 386), las reacciones adversas más comunes (≥ 1 por ciento de los sujetos) notificadas durante el tratamiento y durante los 14 días posteriores a la última dosis fueron diarrea (3 por ciento), náuseas (2 por ciento), mareos (1 por ciento) y cefalea (1 por ciento), todas ellas de grado 1 (leve) o grado 2 (moderado).
La dosis recomendada de molnupiravir es de 800 mg (cuatro cápsulas de 200 mg) por vía oral cada 12 horas durante cinco días. No se recomienda utilizarlo más de cinco días, ya que no se ha establecido la seguridad y eficacia de este medicamento en periodos de tiempo superiores.
¿QUÉ PODEMOS ESPERAR DE ESTE MEDICAMENTO ANTIVIRAL?
Los resultados obtenidos con el molnupiravir son claramente esperanzadores, máxime cuando este fármaco es el primer medicamento que se puede administrar de forma cómoda, por vía oral, para el tratamiento de pacientes con riesgo de desarrollar una infección severa o grave.
Sin embargo, surgen algunas cuestiones a las que habrá que dar respuesta: ¿estará disponible de forma ambulatoria en todas las farmacias? Posiblemente sí, pero para su prescripción y dispensación se necesitará confirmación de la infección mediante una PCR, que tendrá que realizarse en los centros de Atención Primaria. Por otro lado está la cuestión del precio, que se estima en unos 600 euros.
En resumen, como ha sucedido con otros antivirales, tenemos que ser cautelosos. Necesitamos más datos de eficacia y de seguridad a largo plazo, sobre todo en población anciana y, además, cómo se va a comportar el virus frente a esta nueva agresión. Es por ello que las agencias reguladoras van a seguir evaluando este fármaco de forma continua.

En cualquier caso, el molnupiravir parece un avance bastante relevante en la lucha contra la COVID-19. Esto, junto a la eficacia preventiva ya demostrada de las vacunas, nos permite ver más cerca la luz al final del túnel. Tal vez el nombre de este fármaco antiviral, que procede de “Mjölnir”, el martillo del dios escandinavo del trueno Thor, sea una metáfora que realmente suponga el fin del virus SARS-CoV-2.



















































